|
L'entropia (parola che significa letteralmente "cambiamento verso l'interno", o "rivolgimento interno"): è la grandezza che misura la temperatura dell'energia.
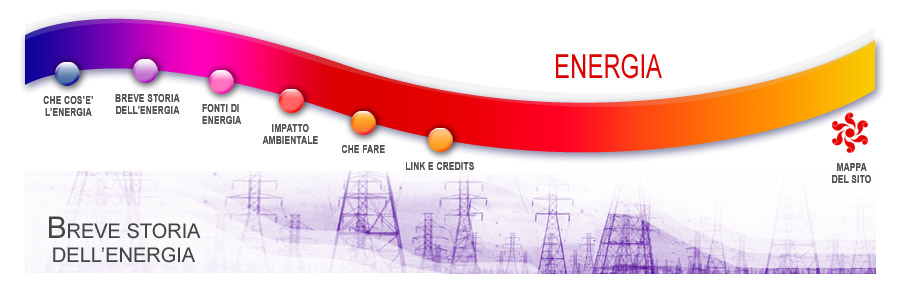
Possiamo affermare che se un gas possiede una data quantità di energia termica (ad esempio il vapore ad alta temperatura prodotto dalla caldaia della locomotiva), ha bassa entropia, mentre la stessa quantità di energia termica, posseduta dal vapore a bassa temperatura (ad esempio nei fumi di scarico che escono dal camino della locomotiva, portando con sé i residui incombusti del carbone), ha un valore alto d'entropia. Affermare, come fece Carnot, che non è possibile far scorrere il calorico da una temperatura bassa ad una più alta, è del tutto equivalente ad affermare che l'entropia aumenta sempre.
La termodinamica vede i sistemi reali non più come macchine meccaniche, ma come macchine termiche, che trasformano l'energia da una forma ad un'altra, spostando l'attenzione dalla invarianza al "divenire" del mondo.
|
|
|
Il calore, è noto a tutti, si trasferisce da zone a temperatura più elevata a zone a temperatura minore. Questo è un processo spontaneo che si verifica in natura senza bisogno di nessuna attività esterna. Il processo inverso, ovvero quello che trasferisce calore da zone a temperatura più bassa a zone a temperatura più elevata non si verifica spontaneamente e richiede l'ausilio di una macchina frigorifera. Potremmo pertanto pensare che un frigorifero violi il secondo principio della termodinamica: se il calore si trasferisce da un corpo caldo ad uno freddo, com'è che il frigorifero estrae calore dal cibo, raffreddandolo, e lo rilascia all'ambiente circostante, la cucina, che è più caldo?
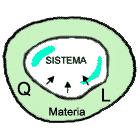
Schematicamente il ciclo frigorifero è così concepito: per sottrarre una quantità di calore Q(i) a una sorgente termica che si trova ad una temperatura T(i) e cedere una quantità di calore Q(s) all'ambiente a temperatura T(s) superiore a T(i), occorre fornire alla macchina frigorifera una quantità di lavoro utili L(e). E' l'intero sistema, compresa la fonte energetica del lavoro utile, che consente le trasformazioni del ciclo frigorifero in cui la quantità di energia presente nel sistema si conserva (primo principio della termodinamica) mentre la qualità dell'energia diminuisce (secondo principio della termodinamica) con il conseguente aumento di entropia del sistema.
Il fisico tedesco Rudolf Clausius (1922-88) enunciò la prima e la seconda legge della termodinamica nel modo seguente:
prima legge
- L'energia dell'universo è costante
seconda legge
- L'entropia dell'universo tende ad aumentare
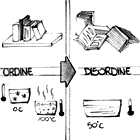
Il significato d'entropia assume così sfumature sottili e profonde. Pensiamo a due corpi come ad un unico insieme, con una data quantità d'energia e a temperature differenti, e poniamoli in contatto tra loro: i due corpi saranno in equilibrio termico quando avranno raggiunto la stessa temperatura, poiché il calore passa spontaneamente dal corpo più caldo a quello più freddo. Dunque l'entropia deve aumentare per raggiungere l'equilibrio. Questo sta affermare che una bassa entropia rappresenta stati ordinati mentre un'alta entropia rappresenta i moti casuali di un sistema in equilibrio.
In termodinamica bisogna considerare l'insieme, non solamente una parte: come abbiamo visto per il ciclo frigorifero, non si può ridurre l'entropia di una cosa senza aumentare l'entropia di qualcos'altro.
Così, nel ciclo di Carnot il rendimento o efficienza del motore termico obbedisce alla regola secondo la quale solo una parte dell'energia termica del combustibile si può trasformare in lavoro utile, per cui l'entropia aumenta sempre, per via degli effetti dissipativi degli attriti.
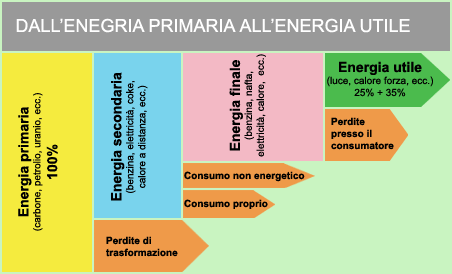
Una regola empirica afferma che solamente un terzo del contenuto energetico di una fonte di calore (ad esempio quella posseduta dal carbone), può essere convertito in una differente forma d'energia utilizzabile (ad esempio in energia elettrica).
|
|